LES EFFETS DU TRAITEMENT BIOLOGIQUE ANAÉROBIE SUR L’HYGIÉNISATION DES FUMIERS
Par Catherine Roy, agr. M.Sc.
Chargée de projets – Agronomie
Le traitement biologique anaérobie permet de traiter la désodorisation, la stabilisation et la déshydratation des lisiers/fumiers, ainsi que d’hygiéniser les coproduits dérivés du fumier initial comme le digestat issu de la biométhanisation (MAPAQ, 2020). La température, le pH, le temps de séjour, les acides gras volatils, les espèces bactériennes, la disponibilité des nutriments ainsi que la quantité initiale de pathogènes sont des paramètres pouvant influencer la croissance des pathogènes en traitement biologique anaérobie (Sahlström et al. 2003).
Les températures supérieures à 40oC causent une réduction du taux de croissance des bactéries pathogènes et de nombreux virus (Sahlström et al. 2003). En traitement biologique anaérobie mésophile, la température est maintenue environ à cette température, ce qui permet d’avoir un environnement hygiénisant contre plusieurs pathogènes. De plus, plus le temps de séjour à l’intérieur des digesteurs est long, plus la limitation de croissance des pathogènes est importante, et plus le pH du digestat est élevé, plus les conditions sont moins favorables pour la croissance de pathogènes. Le digestat a un pH plus élevé que l’intrant initial suite à l’utilisation des ions H+ par les bactéries méthanogènes pour former du biométhane, ce qui permet de limiter la croissance des pathogènes dans le digestat.
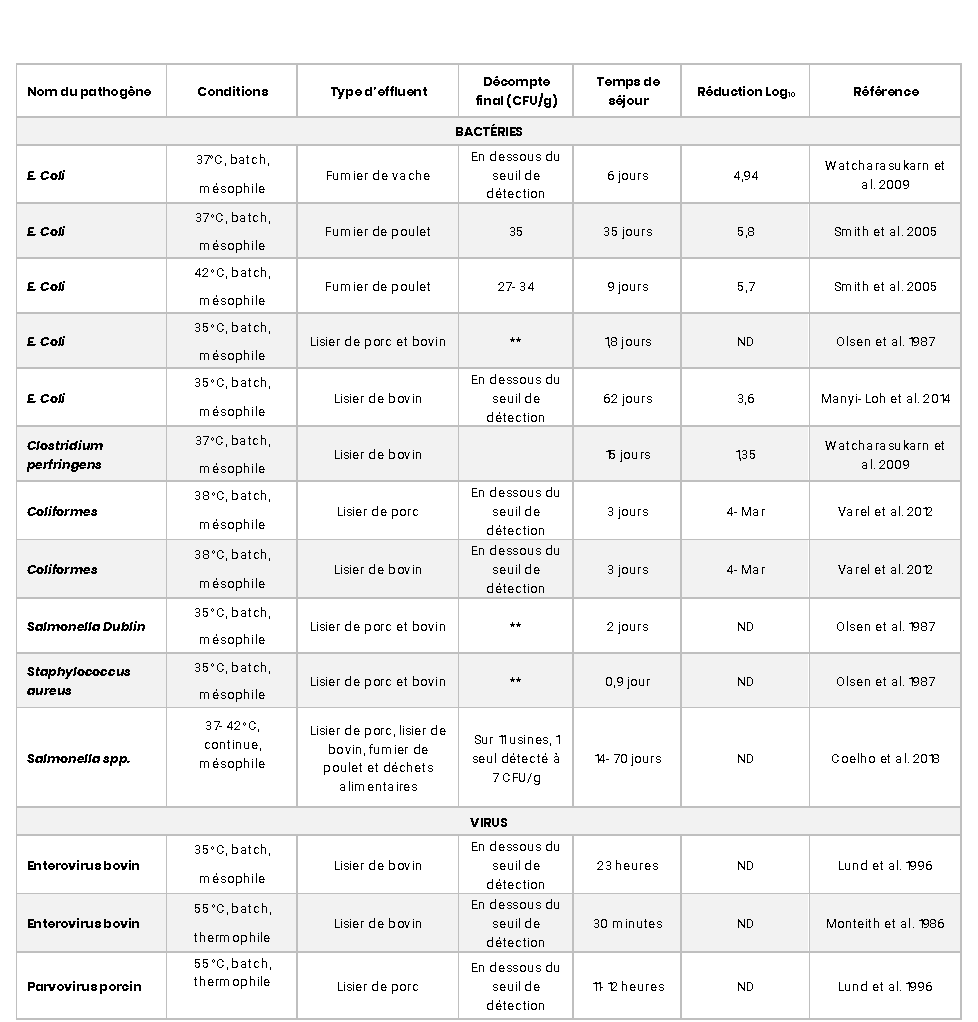
Chez BioÉnertek, le traitement biologique anaérobie mésophile a des temps de rétention 40 et 80 jours pour le lisier et le fumier solide respectivement dans les digesteurs, maintenu à environ 40oC (mésophile). En biométhanisation mésophile, en plus de la température qui joue un rôle sur la croissance des pathogènes, elle augmente la compétition entre les bactéries méthanogènes et les pathogènes pour les nutriments, ce qui peut aider à diminuer ces dernières (Smith et al. 2005). De nombreuses données de la littérature démontrent l’efficacité de la digestion anaérobie dans le processus d’hygiénisation des fumiers (Tableau 1).
UN APERÇU DES BACTÉRIES PATHOGÈNES
L’étude de Coelho et al. (2018), assez récente, a démontré que sur 11 unités de méthanisation mésophiles au Royaume Uni et en Irlande, seulement 1 échantillon contenait du Salmonella spp et ce à très faible concentration (7 CFU/10g de poids frais). E. Coli a été trouvé dans seulement 2 échantillons en très faibles concentrations également, ce qui démontre l’effet hygiénisant d’une biométhanisation mésophile. Dans l’étude de Pandey et al. (2011), pour obtenir une réduction de plus de 90% du taux de survie de E. Coli, le fumier doit être en condition mésophile (42oC) sur 20 jours en digesteur anaérobie. Smith et al. (2005) ont conclu qu’un temps de séjour de 35 jours permettait de réduire E. Coli jusqu’à 5,8 log10 à 35oC et de 5,7 log10 à 42 oC en 9 jours. Une disparition sous le seuil de détection pour E. Coli est observée dans plusieurs autres études en condition anaérobie mésophile entre 1,8 et 64 jours (Olsen et al. 1987; Watcharasukarn et al. 2009; Pandey et al. 2011; Varel et al. 2012; Manyi-Loh et al. 2014, etc.). Pour ce qui est des coliformes, Varel et al. (2012) ont démontré que ces bactéries pouvaient avoir une réduction jusqu’à 3-4 Log10 avec un temps de séjour de 3 jours dans du lisier de porc et bovin en condition mésophile.
Les bactéries sporulantes de type Clostridium sont résistantes à la chaleur. Ce sont des bactéries que l’on retrouve naturellement dans les sols. Les études de Fröschle et al. (2015) et Bagge et al. (2005) démontrent des quantités similaires de Clostridium entre le fumier initial et le digestat. Toutefois, dans l’étude de Watcharasukarn et al. (2009), ils ont observé une petite réduction de 1,35 log10 après un temps de séjour de 15 jours du fumier en condition anaérobie mésophile pour Clostridium perfringens, et suggèrent dans leur discussion d’augmenter le temps de séjour au-dessus de 20 jours et garder une température à plus de 70oC afin d’obtenir une réduction log10 plus élevée.
Mycobacterium avium subsp. paratuberculosis (MAP) n’est plus dénombrable après 28 jours de temps de rétention dans les digesteurs de l’étude de Olsen et al. (1985), et au bout de 24 heures en mode thermophile (≥ 50◦C).
UN APERÇU DES VIRUS
Selon Bötner et Behlsam (2012), la température est le paramètre ayant le plus d’impact sur les virus animaux. En condition mésophile, on parle de quelques heures avant que les virus soient inactivés pour les entérovirus porcins (McKain et Hobson, 1987). Le temps de réduction décimal le plus long est pour le PPV (virus de la parvovirus porcine), nécessitant 8 jours à 55◦C et 21 semaines à 35◦C pour être totalement inactivé.
Pour ce qui est du virus Influenza aviaire Hautement Pathogène, tout dépend des souches. En général, ce virus est très sensible à la chaleur, au pH, au contenu en matière organique, à la salinité, etc. Pour la souche H9N2, 37◦C assure une inactivation entre 3 à 5 jours (Davidson et al. 2010). Pour H5N1, le temps d’inactivation est d’environ 50 jours à 30◦C (Paek et al. 2010).
Pour le virus de la peste porcine africaine, il est très sensible à la chaleur. Turner et al. (1998) démontrent que la population virale est en déclin à partir de 50◦C en 24 heures et en quelques minutes à 60◦C. Néanmoins, la mise en place d’une bonne gestion de biosécurité à la ferme est de mise.
Selon Lund et al. 1996, l’entérovirus bovin a besoin de 23 heures en condition mésophile (35oC) et de 30 minutes en condition thermophile (55oC) pour atteindre le seuil de détection minimal dans le digestat.
UN APERÇU DES PARASITES
Pour ce qui est des parasites, aucune trace d’helminthes, cestodes ni de protozoaires ont été trouvés dans les intrants ni dans le digestat lors du processus de méthanisation mésophile de l’étude de Bonetta et al. (2014). Dans l’étude de Pecson et al. (2007), l’objectif était de dénombrer les œufs d’Ascaris suum dans des eaux usées traitées biologiquement. On parle d’une réduction en dessous du seuil de détection pour un temps de séjour de 12 jours à 40oC. Dans l’étude de Lee et al. 1988, on parle d’une inactivation de l’effet sporulant d’Eimeria tenella dans du fumier de poulet en digestion anaérobie thermophile (50oC).
Tableau 1
Quantité de pathogènes observé dans le produit final de différents traitements biologiques anaérobies, selon plusieurs études
À LA FERME
Il n’est pas nouveau que les fermes doivent se procurer du lisier ou du fumier à l’extérieur afin de combler les besoins en nutriments de leurs parcelles. Le nom de la ferme qui exporte l’effluent, le type de fumier, la quantité et les analyses en N, P2O5 et K2O sont des éléments que l’on retrouve dans le Plan Agroenvironnemental de Fertilisation (PAEF) de chacune des fermes qui épand dans ses champs et qui importe du lisier ou fumier à la ferme.
Les producteurs achètent et louent de plus en plus de parcelles, c’est pourquoi les demandes en lisier et fumier sont élevées et que plusieurs producteurs agricoles doivent se procurer ces effluents chez leurs voisins, ce qui représente déjà du voyagement de lisier et fumier d’une ferme à l’autre, donc un risque de contamination. Certes, il va de soi que la qualité initiale de l’intrant joue un rôle important dans la croissance des bactéries pathogènes, peu importe s’il s’agit du fumier initial ou du digestat. Si la qualité initiale est faible, elle sera faible ou inexistante suite au processus de traitement biologique anaérobie. Tout part d’une bonne biosécurité à la ferme.
POST-DIGESTION ANAÉROBIE
Le digestat peut être recontaminé si on utilise un processus de pasteurisation post-digestion, ce qui peut être expliqué par l’absence de compétition avec les autres bactéries, ce qui incite les pathogènes extérieurs à se développer (Bagge et al. 2005). Le retour au sol des digestats doit donc se faire avec les mêmes bonnes pratiques d’hygiène que les épandages d’effluents bruts : pas de pâturage avant 21 jours sur des parcelles ayant reçu du digestat, ne pas manger ni boire sur les lieux d’épandage, mettre en place un plan de maîtrise sanitaire sur les unités de méthanisation.
EN CONCLUSION…
On peut conclure que le traitement biologique anaérobie mésophile des fumiers et lisiers permet de limiter la croissance de beaucoup de pathogènes, dont E.Coli, les coliformes fécaux, Salmonella spp., notamment à cause de la température élevée et ce même en condition mésophile (± 40oC) et le temps de séjour, la littérature scientifique peut le prouver. De plus, le pH du résultat final, la compétition contre les bactéries méthanogènes (responsable de la production du biogaz) et autres microorganismes sont aussi des paramètres influençant le contenu de ces pathogènes dans le produit final (Sahlström et al. 2003). Certains virus comme le parvovirus porcin disparait en quelques heures en condition thermophile, ce qui devrait représenter quelques jours en condition mésophile (Jiang et al. 2020). Beaucoup d’autres études démontrent les effets positifs de la digestion anaérobie sur l’hygiénisation des fumiers (notamment Lin et al. 2022).
Il faut également garder en tête que les producteurs agricoles importent et exportent du lisier et fumier avec leurs voisins (règlementé par le Plan Agroenvironnemental de Fertilisation), ce qui fut et fera toujours partie du quotidien étant donné le déficit en fertilisants organiques de certaines fermes.
Les temps de rétention du lisier et fumier liquide du traitement biologique anaérobie BioÉnertek sont assez long pour réduire suffisamment les bactéries pathogènes les plus communes, plusieurs virus et mêmes les parasites. Les conditions sont défavorables à la croissance des pathogènes en condition mésophile, et les producteurs suivent chacun leur plan de biosécurité à la lettre afin de réduire au maximum l’incidence de pathogènes à la ferme. À la ferme, il faut se rappeler que pathogène est synonyme de maladie, et maladie est synonyme de perte de revenus. Les producteurs le savent et sont sensibilisé à ce sujet.
RÉFÉRENCES
Bagge, E., Sahlström, L. et A. Albihn. 2005. The effect of hygienic treatment on the microbial flora of biowaste at biogas plants. Water Res. 39, 4879–4886.
Bonetta, Si, Ferretti, E., Bonetta, Sa, Fezia, G. et E. Carraro. 2011. Microbiological contamination of digested products from anaerobic co‐digestion of bovine manure and agricultural by‐products. Appl Microbiol. 53, 552–557.
Coelho, J.J., Prieto, M.L., Dowling, S., Hennessy, A., Casey, I., Woodcock, T. et N. Kennedy. 2018. Physical-chemical traits, phytotoxicity and pathogen detection in liquid anaerobic digestates. Waste Manag. 78, 8–15.
Davidson, I., S. Nagar, R. Haddas, M. Ben-Shabat, N. Golender, E. Lapin, A. Altory, L. Simanov, I. Ribshtein, A. Panshin et S. Perk. 2010. Avian Influenza Virus H9N2 Survival at Different temperatures and pHS. Avian Diseases. 54(1 Suppl):725-8.
Kearney, T.E., Larkin, M.J., Frost, J.P. et P.N. Levett. 1993. Survival of pathogenic bacteria during mesophilic anaerobic digestion of animal waste. J Appl Bacteriol. 75, 215–219.
Lee, M.R. et J.C. Shih. 1988. Effect of anaerobic digestion on oocysts of the protozoan Eimeria tenella. Appl Environ Microbiol. 54(10):2335-41.
Lin, M., Aijie, W., Lijuan R., Wei, Q., Simon, M.W. et D. Renjie. 2022. Challenges of pathogen inactivation in animal manure through anaerobic digestion: a short review, Bioengineered. 13:1, 1149-1161.
Lund, B., Jensen, V.F., Have, P. et B. Ahring. 1996. Inactivation of virus during anaerobic digestion of manure in laboratory scale biogas reactors. Antonie van Leeuwenhoek. 69:25–31.
Manyi-Loh, C.E., Mamphweli, S.N., Meyer, E.L., Okoh, A.I., Makaka, G., et M. Simon. 2014. Inactivation of selected bacterial pathogens in dairy cattle manure by mesophilic anaerobic digestion (Balloon type digester). Int J Environ Res Public Health. 11(7):7184–7194.
McKain, N. et P.N. Hobson. 1987. A note on the destruction of procine enteroviruses in anaerobic digestions. Biol Wastes. 22:147-155.
Monteith, H., Shannon, E. et J. Derbyshire. 1986. The inactivation of a bovine enterovirus and a bovine parvovirus in cattle manure by anaerobic digestion, heat treatment, gamma irradiation, ensilage and composting. Journal of Hygiene. 97(1):175-184.
Olsen, J.E. et H.E. Larsen. 1987. Bacterial decimation times in anaerobic digestions of animal slurries. Biological Wastes. 21(3):153–168.
Paek, M.R., Lee, Y.J., Yoon, H., Kang, H.M., Kim, M.C., Choi, J.G., Jeong, O.M., Kwon, O.S., Moon, O.K., Lee, S.J. et J.H. Kwon. 2010. Survival rate of H5N1 highly pathogenic avian influenza viruses at different temperatures. Poultry Science 89 :1647–1650.
Pandey, P.K. et M.L. Soupir. 2011. Escherichia coli inactivation kinetics in anaerobic digestion of dairy manure under moderate, mesophilic and thermophilic temperatures. Amb Express. 1(1):18.
Park, J.H., Cheong, H.K., Son, D.Y., Kim, S.U. et C.M. Ha. 2010. Perceptions and behaviors related to hand hygiene for the prevention of H1N1 influenza transmission among Korean university students during the peak pandemic period. BMC Infect Dis. 10. 222.
Pecson, B., Barrios, J., Jiménez, B. et K. Nelson. 2007. The effects of temperature, pH, and ammonia concentration on the inactivation of Ascaris eggs in sewage sludge. Water research. 41. 2893-902.
Sahlstrom, L., 2003. A review of survival of pathogenic bacteria in organic waste used in biogas plants. Bioresour. Technol. 6.
Smith, S.R., Lang N.L., Cheung K.H.M. et K. Spanoudaki. 2005. Factors controlling pathogen destruction during anaerobic digestion of biowastes. Waste Manag. 25 (4):417–425.
Sorlini, C., Allievi, L., Ranalli, G., Ferrari, A. 1987. A note on the removal of fecal bacteria in cattle slurry after different farm and laboratory treatments. Biol. Wastes. 22:39–47.
Turner, C. et C.H. Burton. 1997. The inactivation of viruses in pig slurries: A review. Bioresour. Technol. 61, 9–20.
Varel, V.H., Wells, J.E., Shelver, W.L., Rice, C.P., Armstrong, D.L. et D.B. Parker. 2012. Effect of anaerobic digestion temperature on odour, coliforms and chlortetracycline in swine manure or monensin in cattle manure. J Appl Microbiol. 112(4):705–715.
Watcharasukarn, M., Kaparaju, P., Steyer, J.P., Krogfelt, K.A. et I. Angelidaki. 2009. Screening Escherichia coli, enterococcus faecalis, and Clostridium perfringens as indicator organisms in evaluating pathogen-reducing capacity in biogas plants. Microb Ecol. 58(2):221–230.